GLP-1RA治疗T2DM患者具有明确的心血管获益,与其抗动脉粥样硬化密不可分!
来源:程时武 2024-04-26 10:28
截止至目前为止,糖尿病仍然是全球范围内的重大疾病之一,根据国际糖尿病联盟(IDF)的数据,2019年全球糖尿病患病率估计为9.3%,约有4.63亿人患有糖尿病。
1.糖尿病相关心血管不良事件现状
截止至目前为止,糖尿病仍然是全球范围内的重大疾病之一,根据国际糖尿病联盟(IDF)的数据,2019年全球糖尿病患病率估计为9.3%,约有4.63亿人患有糖尿病,到2030年,糖尿病的全球预计患病率将增加到10.2%(5.78亿),到2045年将增加到10.9%(7亿)[1]。除了具有发病率高的特点外,糖尿病还是全球范围内死亡和残疾的主要原因,其中心血管并发症占据着重要因素,约占26.8%[2]。在确定排除了传统心血管疾病的危险因素后,包括年龄、肥胖、吸烟、血脂异常和高血压等,糖尿病患者发生心血管不良事件的几率明显高于非糖尿病患者。糖尿病并发的心血管不良事件,不仅给患者的生活质量和生命健康造成了严重威胁,同时也给全球范围内的患者和医疗保健系统带来了巨大的经济负担,具有严重的危害性。因此,全面和深入了解糖尿病的心血管不良事件风险,以确定早期预防和干预的策略,对于保障糖尿病患者生命健康安全具有重要的意义。
近年来,由于对糖尿病不良并发症认识的加深和各类新型药物的研发、验证和应用,糖尿病患者的心血管风险呈现出一定的下降趋势。冠心病又称为动脉粥样硬化性心脏病,是心血管不良并发症的主要类型,可表现为稳定性心绞痛、不稳定性心绞痛、心肌梗死和心源性猝死。动脉粥样硬化及其危险因素均促进多种心血管事件的发生,并导致死亡[3](见表1)。在全球范围内有高达32.2%的2型糖尿病(T2DM)患者可并发冠心病[4]。因此,如何应对动脉粥样硬化性心脏病是近年来糖尿病治疗的重点和热点问题。
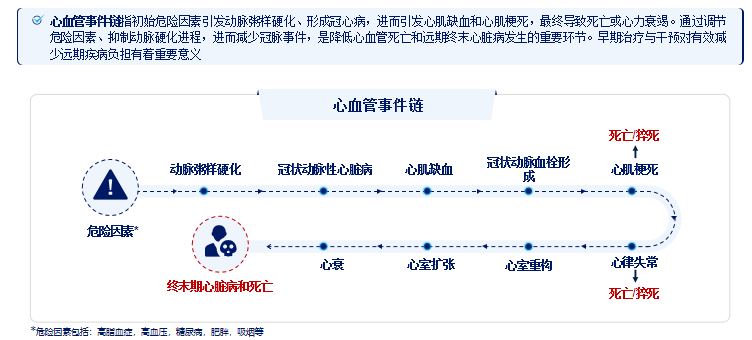
图1.动脉粥样硬化在心血管事件链中的作用
2.糖尿病相关心血管不良事件管理的新进展
糖尿病相关的心血管不良事件等并发症,给糖尿病的管理策略带来了严峻的挑战,但同时,多项有关评估糖尿病治疗药物的心血管结局试验(CVOT)正在进行或已经完成,为新阶段的糖尿病防治心血管疾病治疗提供了全新的见解和应对方案。
肠促胰素,包括胰高血糖素样肽-1(GLP-1)和葡萄糖依赖性胰岛素性多肽(GIP),均属于肠道激素,在营养摄入时分泌,并通过调节胰岛素和胰高血糖素释放来维持血糖控制。GLP-1受体激动剂(GLP-1RA)可通过刺激肠源性肠促胰素的作用或抑制其降解来改善葡萄糖调节,从而起到控制糖尿病患者血糖的作用。此外,根据美国食品和药物管理局的指导意见,新的降糖药物要确保心血管安全性,以应对糖尿病相关的心血管事件并发症的挑战。CVOT研究中主要以心血管死亡、非致死性心肌梗死和非致死性卒中为不良心血管终点(MACE),对GLP-1RA等糖尿病治疗药物的MACE进行了全面的评估。最新的荟萃分析显示,对于合并心脑血管疾病或心脑血管高危因素的T2DM患者,GLP-1RA药物可使其MACE获益,在T2DM患者中,GLP-1RA类药物对心血管病的二级预防与一级预防有效性一致[5](见图2)。

图2. 荟萃分析显示GLP-1RA可使T2DM患者MACE获益
LEADER研究表明,在心血管高危的T2DM患者中,利拉鲁肽较安慰剂显示出显著的心血管获益[6]。来自LEADER研究的另一项分析显示利拉鲁肽还具有降低T2DM合并心血管高危患者的心肌梗死发生率,并可能改善患者心肌梗死的临床结局[7]。CVOT荟萃分析提示,GLP-1RA总体降低MACE风险达14%,其中利拉鲁肽降低MACE风险13%,司美格鲁肽降低MACE风险达26%[8]。大量研究证实GLP-1在人体内具有多重重要的生理作用,GLP-1RA通过激活GLP-1受体以葡萄糖浓度依赖性刺激胰岛素分泌、诱导β细胞增殖及增强对细胞凋亡的抵抗力,还通过直接作用于脂肪组织来促进能量储存,并通过刺激成骨细胞增殖和抑制细胞凋亡来增强骨形成,并可通过调控血压、炎症、血脂异常和微血管功能等动脉粥样硬化的危险因素来达到减少心血管并发症的目的[9](见表3)。
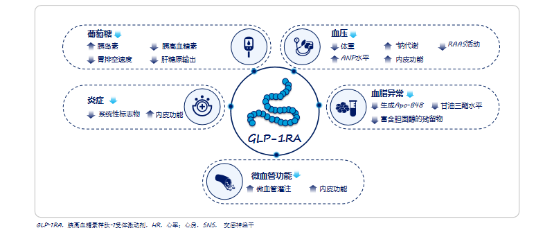
图3.GLP-1改善多种动脉粥样硬化的危险因素
3.GLP-1RA抑制动脉粥样硬化的机制
动脉粥样硬化的形成和进展是一个复杂的过程,在血管内皮受损的基础上,循环中的低密度脂蛋白(LDL)颗粒从血管腔被运输到血管壁,在细胞外基质中聚积,从而更容易发生氧化,巨噬细胞和平滑肌细胞吞噬脂质后形成泡沫细胞,促进动脉粥样硬化斑块的形成。GLP-1RA可通过减少极低密度脂蛋白、体内泡沫细胞、体内巨噬细胞、内皮功能障碍和氧化应激等多种途径抑制动脉粥样硬化的发生和发展[10](见图4)。
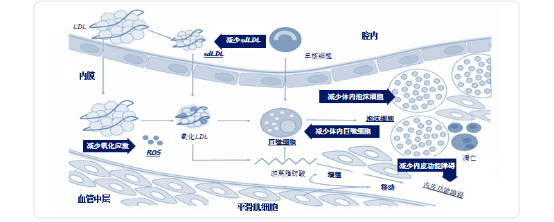
图4.GLP-1RA抑制动脉粥样硬化的多种机制
一项动物研究显示,司美格鲁肽和利拉鲁肽等GLP-1RA显著减轻了载脂蛋白E(ApoE)缺陷小鼠和低密度脂蛋白受体缺陷(LDLr)小鼠的斑块病变发展。GLP-1RA可能通过作用于白细胞募集、白细胞滚动、粘附/外渗、胆固醇代谢、脂质介导的信号传导、细胞外基质蛋白转换等多种途径和其抗炎机制来抑制动脉粥样硬化斑块的形成[11](见图5)。
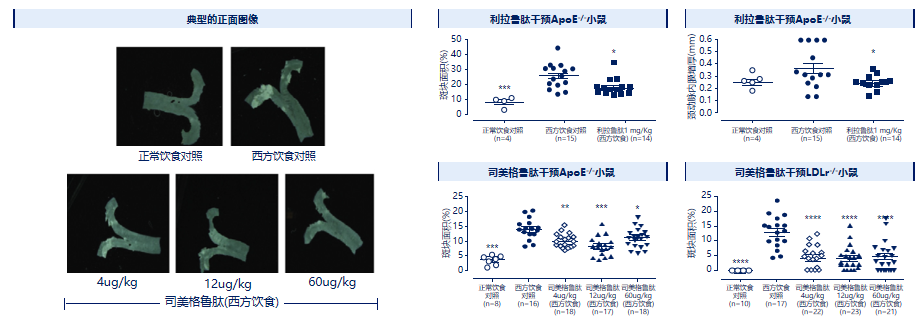
图5.GLP-1RA减少高脂饮食诱导的动脉粥样硬化斑块形成
另一项动物研究显示,使用腺病毒载体系统转染ApoE-/-小鼠模型,并给予西方饮食喂养诱导动脉粥样硬化,取小鼠主动脉根部和主动脉弓进行油红染色(Oil-red-O)及天狼猩红染色(PSR)染色观察。结果显示,GLP-1(7-37)、GLP-1(9-37)和GLP-1(28-37)可显著减少小鼠动脉粥样硬化脂质核心并增加纤维帽厚度,达到稳定斑块作用[12](见图6)。
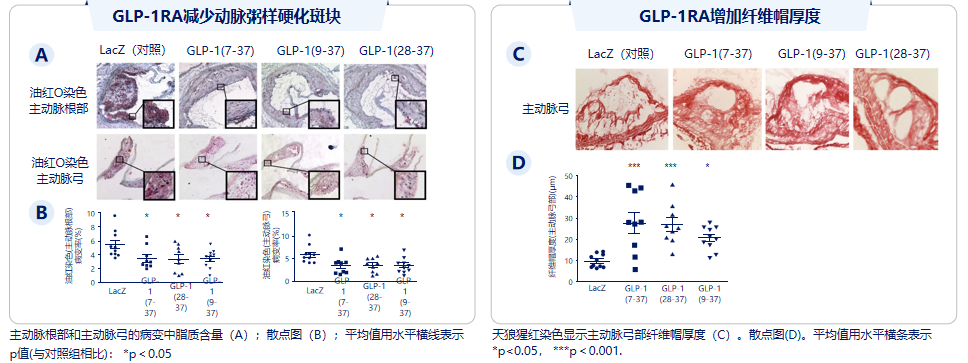
图6.GLP-1RA减少动脉粥样硬化斑块脂质核心及增加纤维帽厚度(稳定斑块)
4.总结
糖尿病相关心血管不良事件仍是糖尿病管理中面临的重大挑战,我们仍需重视心血管并发症的危害。GLP-1RA相关的CVOT试验和其他新进展均证实了包括利拉鲁肽和司美格鲁肽在内的GLP-1RA药物在降糖可靠的基础上,具有显著的抑制动脉粥样硬化进展的作用,并可进一步降低心血管不良事件,这对提高患者生活质量和降低死亡等不良结局均具有十分重要的价值。
参考文献
[1]Saeedi P , Petersohn I, Salpea P , et al. Global and regional diabetes prev-alence estimates for 2019 and projections for 2030 and 2045: results from the International Diabetes Federation Diabetes Atlas. Diabetes Res Clin Pract. 2019;157:107843.
[2]Ling W , Huang Y , Huang YM, et al. Global trend of diabetes mortality attributed to vascular complications, 2000–2016. Cardiovasc Diabetol. 2020;19:182
[3]Dzau VJ, Antman EM, Black HR, et al. The cardiovascular disease continuum validated: clinical evidence of improved patient outcomes: part I: Pathophysiology and clinical trial evidence (risk factors through stable coronary artery disease). Circulation. 2006;114(25):2850-2870.
[4] Einarson TR, Acs A, Ludwig C, et al. Prevalence of cardiovascular disease in type 2 diabetes: a systematic literature review of scientific evidence from across the world in 2007–2017. Cardiovasc Diabetol. 2018;17:83.
[5]Sattar N et al. Lancet Diabetes Endocrinol. 2021; S2213-8587(21)00203-5.
[6]Verma S, Poulter NR, Bhatt DL, et al. Effects of liraglutide oncardiovascular outcomes in patients with type 2 diabetes mellitus with or without history of myocardial infarction or stroke. Circulation 2018;138:2884–2894
[7]Marso SP, Nauck MA, Monk Fries T, Rasmussen S, Treppendahl MB, Buse JB: Myocardial Infarction Subtypes in Patients With Type 2 Diabetes Mellitus and the Effect of Liraglutide Therapy (from the LEADER Trial). Am J Cardiol. 2018; 121(12):1467-1470.
[8]Sattar N, Lee MMY,Kristensen SL,et al.Cardiovascular, mortality, and kidney outcomes with GLP-1 receptor agonists in patients with type 2 diabetes: a systematic review and meta-analysis of randomised trials.Lancet Diabetes Endocrinol. 2021;9(10):653-662.
[9]Dzau VJ, Antman EM, Black HR, et al. The cardiovascular disease continuum validated: clinical evidence of improved patient outcomes: part I: Pathophysiology and clinical trial evidence (risk factors through stable coronary artery disease). Circulation. 2006;114(25):2850-2870.
[10]Rizzo M, Nikolic D, Patti AM, et al. GLP-1 receptor agonists and reduction of cardiometabolic risk: Potential underlying mechanisms. Biochim Biophys Acta Mol Basis Dis. 2018;1864(9 Pt B):2814-2821.
[11]Rakipovski G, Rolin B, Nøhr J, et al. The GLP-1 Analogs Liraglutide and Semaglutide Reduce Atherosclerosis in ApoE and LDLr Mice by a Mechanism That Includes Inflammatory Pathways. JACC Basic Transl Sci. 2018;3(6):844-857. Published 2018 Nov 21.
[12]Burgmaier M, Liberman A, Möllmann J, et al. Glucagon-like peptide-1 (GLP-1) and its split products GLP-1(9-37) and GLP-1(28-37) stabilize atherosclerotic lesions in apoe⁻/⁻ mice. Atherosclerosis. 2013;231(2):427-435.
作者简介:

程时武 教授
解放军第923医院内分泌科主任,副主任医师,医学博士
毕业于第四军医大学、解放军301医院
广西医师协会内分泌代谢科医师分会副主任委员
广西医学会内分泌学分会常委
广西医学会糖尿病学分会委员
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


